Nồng phỏng mol là gì, bao gồm những dạng bài bác tập luyện cần thiết, thông thường gặp gỡ vô công tác chất hóa học trung học tập. Vậy nó được xem như vậy nào? Hãy nằm trong VietChem thám thính hiểu cụ thể vô nội dung bài viết sau và tìm hiểu thêm một số trong những bài bác tập luyện áp dụng nhằm làm rõ rộng lớn nhé.
Nồng phỏng mol là gì?
Nồng phỏng mol biểu thị cho tới số mol của một hóa học tan vô một lít dụng dịch, nó được kí hiệu là M
Bạn đang xem: các công thức tính số mol
Ví dụ: Trong 4 lít hỗn hợp chứa chấp 2 mol phân tử tan tạo ra hỗn hợp 0,5 M hoặc thường hay gọi là 0,5 phân tử gam.
Ngày ni mol được sử dụng thoáng rộng vô chất hóa học nhằm thể hiện tại lượng hóa học phản xạ nằm trong thành phầm của những phản xạ học tập. Bên cạnh đó, nó còn được dùng nhằm biểu thị con số nguyên vẹn tử, những thực thể không giống nhau vô một kiểu mẫu chắc chắn của một hóa học hoặc ion.

Nồng phỏng mol là gì
>>>XEM THÊM: Chất thải nguy hiểm kinh hãi - Phân loại, mã color quy ấn định và cơ hội xử lý
Chất thải nguy hiểm kinh hãi - Phân loại, mã color quy ấn định và cơ hội xử lý
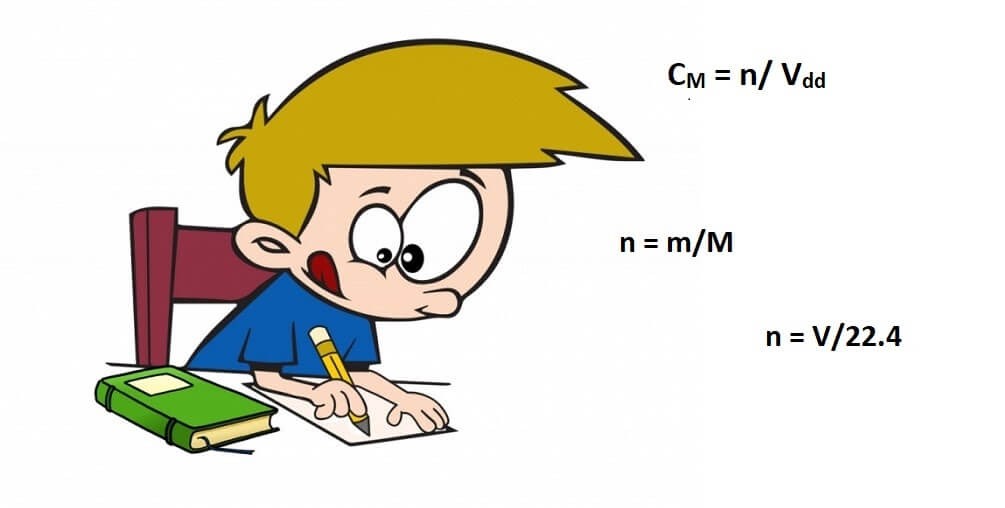
Công thức tính mật độ mol
- Ta với công thức:
CM = n/ Vdd
Trong đó:
- CM là mật độ mol
- n là số mol hóa học tan
- Vdd là thể tích hỗn hợp (đơn vị tính: lít)
Công thức tính số mol đơn giản
1. Cách tính số mol qua loa thể tích
n = V/22.4
Trong đó:
- n là số mol hóa học khí bên trên ĐK chi tiêu chuẩn chỉnh (đktc) với đơn vị chức năng tính: mol
- V: thể tích của hóa học khí ở đktc (tính vị lít)
2. Tính số mol trải qua khối lượng
n = m/M
Trong đó:
- n là số mol, với đơn vị chức năng tính là mol
- m là lượng được xem vị gam
- M là lượng mol hóa học, tính vị g/mol
3. Một số phương pháp tính khác
|
Điều kiện |
Công thức |
Chú thích |
Đơn vị tính |
|
Khi với mật độ mol/lít |
n = CM.V |
- n: số mol chất |
mol |
|
- CM: mật độ mol |
Mol/lit |
||
|
- V: thể tích dung dịch |
lit |
||
|
Khi biết số nguyên vẹn tử hoặc phân tử |
n = A/N |
- A: số nguyên vẹn tử hoặc phân tử |
Nguyên tử hoặc phân tử |
|
- Số Avogadro (số đơn vị chức năng vô bất kể một mol hóa học nào là và có mức giá trị vị 6.1023) Xem thêm: game nhiều người chơi nhất |
|||
|
Tính số mol khí bên trên ĐK thường |
n = Phường.V/R.T |
- P: sít suất |
1 atm = 760mmHg |
|
- V: thể tích khí |
Lít |
||
|
- R: hằng số |
0,082 (hoặc 62400) |
||
|
- T: nhiệt độ phỏng tính theo đuổi phỏng Kelvin (K) |
K = 273 + phỏng C |

Có đặc biệt nhiều phương pháp tính số mol
Tham khảo một số trong những bài bác thói quen mật độ mol
Một số bài bác tập luyện tìm hiểu thêm về kiểu cách tính mật độ mol:
Bài tập luyện 1: Trong 400ml hỗn hợp với hòa tan 32 gam hóa học NaOH. Hãy tính mật độ mol của dung dịch
Lời giải:
- Đổi 400 ml = 0,4 lít
- nNaOH = 36/40 = 0,9 mol
- Theo công thức tính CM tao có:
- Cdd = n/V = 0,9/0,4 = 2,25 (M)
Bài tập luyện 2: Tính CM của 0,5 mol MgCl2 với trong một,5 lít dung dịch
Lời giải:
- Áp dụng vô công thức tính CM tao có:
CM = 0,51 x 5 = 0,33 (mol)
Bài tập luyện 3: Tính mật độ mol của một hỗn hợp chứa chấp 0,5 mol NaCl vô 5 lít hỗn hợp.
Lời giải:
CM = 0,5/5 = 0,1 (mol)
Bài tập luyện 4: Hãy tính mật độ mol của hỗn hợp khi tổ chức hòa tan 15,8g KMnO4 vô 7,2 lít nước.
Lời giải:
- Số mol của hóa học nKMnO4 là:
nKMnO4 = 15,8/ 158 = 0,1 (mol)
- Vậy CM tiếp tục bằng: 0,1/ 7,2 = 0,0139
Bài tập luyện 5: Tiến hành cho tới 6,5 gam kẽm phản xạ một vừa hai phải đầy đủ với 100 ml hỗn hợp axit chohidric (HCl). Hãy:
- a) Tính thể tích của H2 nhận được ở ĐK chi tiêu chuẩn
- b) Tính mật độ mol của hỗn hợp HCl tiếp tục sử dụng
Lời giải:
Xem thêm: tiếng anh tiếng việt
- Theo bài bác rời khỏi tao có:
nZn = 6,5/ 65 = 0,1 mol
- Phương trình phản ứng:
Zn + 2HCl → ZnCl2 + H2
- nZn = nZnCl2 = 0,1 mol
- nHCl = 2nZn = 0,2 mol
- a) VH2 = 0,1 x 22,4 = 2,24 (lít)
- b) CddHCl = 0,2/ 0,1 = 2 (M)
Trên trên đây, VietChem tiếp tục reviews cho mình hiểu cụ thể về nồng phỏng mol là gì na ná phương pháp tính và một số trong những bài bác tập luyện áp dụng cơ bạn dạng. Mong rằng, qua loa nội dung bài viết tiếp tục giúp đỡ bạn làm rõ rộng lớn những yếu tố này và rất có thể vận dụng vô học hành hoặc việc làm. Truy cập kinhtedanang.edu.vn thông thường xuyên để tiếp hiểu nhiều nội dung bài viết hữu ích không giống.










Bình luận